Båtens batteri
Båtens batterier är den energikälla som ska försörja strömförbrukare ombord med elektrisk laddning. Genom att skaffa sig kunskap om hur batterier fungerar och hur de på bästa sätt ska underhållas får man dem att räcka så länge som möjligt. Den här sidan innehåller en faktabeskrivning om batterier, med fokus på ackumulatorer avsedda för fritidsbåtar.
Innehåll:
BlyackumulatornUPP ↵
De flesta batterier bygger på en princip där kemisk energi omvandlas till elektrisk energi. Man utnyttjar det fenomen att en elektromotorisk spänning (ems) kan uppstå mellan metaller som är i förbindelse med en elektrolyt. Batterier delas in i två grupper: primärbatterier och sekundärbatterier. Dessa benämningar har sitt ursprung i att man förr laddade sekundärbatterier från ett primärbatteri. Primärbatterier är sådana som används en gång och sedan slängs. Den kemiska reaktionen som skapar den elektriska energin i dessa batterier är inte reversibel. Sekundärbatterier däremot kan återuppladdas och användas igen. Den kemiska reaktionen i dessa kan omvändas, genom att man istället för att ta ut, tillför ström. Den elektriska energin blir här kemisk energi. Laddningsbara batterier används för att ackumulera energi och kallas därför för ackumulatorer. I fritidsbåtar används uteslutande ackumulatorer och vanligtvis används de som är särskilt anpassade för marint bruk.
Ackumulatorer finns i ett ständigt växande variationsutbud. De vanligaste konstruktionerna är blyackumulatorer, litiumjonackumulatorer (Li-ion) och nickelmetallhydridackumulatorer (NiMH). De sistnämnda har ersatt nickelkadmiumackumulatorer (NiCd), som, p.g.a den miljöfarliga metallen kadmium, numera är förbjuden att användas i konsumentprodukter (vissa undantag finns dock). Litiumjonackumulatorer introducerades på marknaden i början av 1990-talet. Dessa har bl.a. högre energitäthet som ger dem fördelar framför andra ackumulatorer. Litiumjonackumulatorer används i vissa elbilar.
Blyackumulatorn är dock fortfarande den vanligaste typen av ackumulator i bilar och i båtar. Blycellen konstruerades redan 1859 av Gaston Planté, och var den första laddbara cellen. En battericell består av två elektroder (anod och katod) och en elektrolyt. Elektrolyt (av grekiska elektron och ly'sis, "lösning") är en substans innehållande fritt rörliga joner som gör att ämnet blir elektriskt ledande. Genom en kemisk reaktion med elektrolyten skapas elektrisk ström mellan anod och katod.
Kemisk reaktion vid strömuttagUPP ↵
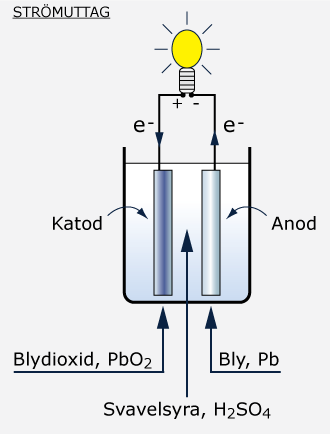
Den negativa polen hos en laddad ackumulator utgörs av en metallplatta med poröst, rent bly (svampbly). Bly har den kemiska beteckningen Pb. När en strömförbrukare kopplas mellan batteriets plus- och minusplattor fungerar den negativa polen som en anod och avger elektroner. Blyet i minusplattan förenas med sulfatjoner i elektrolytens svavelsyra (H2SO4) och bildar blysulfat (PbSO4). I denna process frigörs elektroner som ger upphov till batteriströmmen. Den elektrokemiska reaktionen beskrivs med följande formel:
Pb + SO42- → PbIISO4 + 2e-
Blysulfat är mycket svårlösligt och blir därför kvar som en vit beläggning på den negativa elektroden. Den här processen minskar halten svavel i syran och elektrolyten blir tunnare och lättare.
Den positiva polen består av blydioxid (PbO2) i ett blygaller. Vid strömuttag fungerar den som en katod, det vill säga den tar emot elektroner. Blydioxiden reagerar med vätejoner (H+) och sulfatjoner (SO42-) varpå det bildas blysulfat och vatten (H2O) enligt följande reaktionsformel:
2e- + PbIVO2 + 4H+ + SO42-→ PbIISO4 + 2H2O
I samband med urladdning bildas det således blysulfat även vid den positiva polen. Det vatten som skapas späder ut elektrolytens svavelsyra ytterligare, varvid elektrolytens densitet sjunker.
Urladdningsprocessen fortgår så länge som strömförbrukaren är inkopplad och det finns tillräckligt med sulfatjoner kvar i svavelsyran. När elektrolyten blir alltför tunn avstannar den kemiska reaktionen, batteriets plus- och minusplattor är då kemiskt nästan lika. Om detta inträffar är batteriet urladdat och det är fara å färde. På plattorna uppstår ett tjockt blysulfatskikt som måste avlägsnas, skulle sulfatjonerna få bli kvar där börjar blysulfaten att bilda kristaller som inte kan lösas ut i syran igen. Detta kompliceras sedan ytterligare, i och med att det "friska blysulfatet" blir isolerat och svårare att komma åt. Processen förstärker sig själv. Man kallar det för att batteriet sulfaterar. Detta vill man undvika varför det är viktigt att åtgärda ett urladdat batteri omedelbart, och räddningen är laddning.
Kemisk reaktion vid laddning UPP ↵
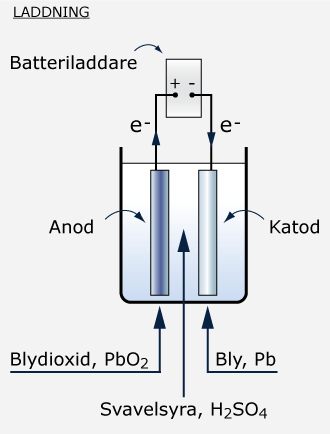
Den kemiska reaktion som sker vid strömuttag är reversibel, d.v.s reaktionen kan också genomföras i motsatt riktning. När ackumulatorn ansluts till en laddningsström kommer plattornas tillstånd att återställas, sulfatjonerna frigörs från blysulfaten och återgår till elektrolyten. Vid laddning kommer minuspolen istället att fungera som en katod och pluspolen som en anod. Den kemiska processen är nu den omvända: blysulfat övergår till bly och sulfatjoner. Koncentrationen av svavel i syran ökar och densiteten stiger. Ackumulatorns elektriska potential byggs upp igen.
Om man har ett urladdat batteri måste det laddas omgående för att inte skadas. Med ett batteri som har sulfaterat finns annars en risk att när en laddningsström kopplas till polerna, åtgår energin mest till att övervinna resistansen. Plattorna värms upp och elektrolyten "kokas" bort.
Hur batteriladdningen ska utföras beror på vilken typ av ackumulator man har. Det är också en procedur som kräver en viss omsorg, varför vi rekommenderar att läsa vidare på informationssidorna: Ackumulatorladdning, Olika laddare och Laddningsregulatorer.
Olika sorters blyackumulatorer UPP ↵
Det finns olika typer av blyackumulatorer och dessa kan delas upp i två huvudgrupper: dels s.k. våtcellsbatterier och dels torra batterier. Ackumulatorer av typen våta blybatterier är vanligast förekommande. Dessa kännetecknas av att de har en fri, flytande elektrolyt/syra i battericellerna. Våta batterier fungerar bra både som start- och förbrukarbatteri, och har oftast lägre kostnad per Ah.
Till gruppen torra batterier hör AGM och GEL ackumulatorer. AGM = Absorbed Glass Matt är en ackumulatortyp där batterivätskan är uppsugen i glasfiberseparatorer, vilket ger ett batteri utan flytande syra. GEL batterier har sin syra i geléform. Torra batterier är i regel mer tåliga mot djupurladdningar och därför lämpliga att använda som förbrukningsbatterier i båtar.
Polspänning, emk och inre resistans UPP ↵
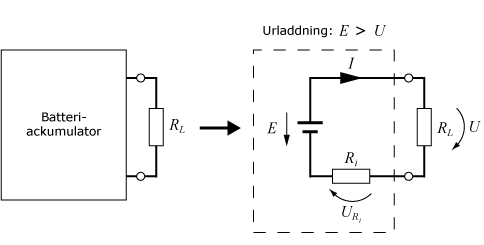
En ackumulator kan liknas vid en tvåpol som, enligt Thévenins teorem, funktionsmässigt går att ersätta med en emk E i serie med en inre resistans Ri, där emk:en utgör en ideal spänningskälla vars spänning är lika med tvåpolens tomgångsspänning. Polspänningen U är det man kan mäta utanför batteriet. Om man ansluter en last, t.ex. en lampa, till batteriet så kommer batteriströmmen I att ge upphov till ett spänningsfall över den inre resistansen URi. Polspänningen blir därför lägre än batteriets emk, E > U.

Om man ansluter en polspänning som är större än batteriets emk, U > E så kommer strömmen att gå i motsatt riktning. För en ackumulator, där de elektrokemiska processerna är reversibla, kommer batteriet då att laddas upp.
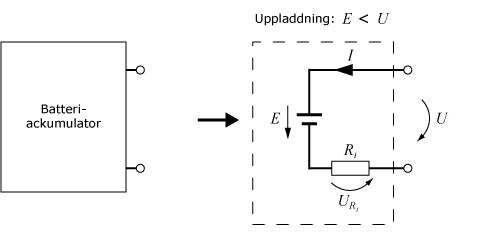
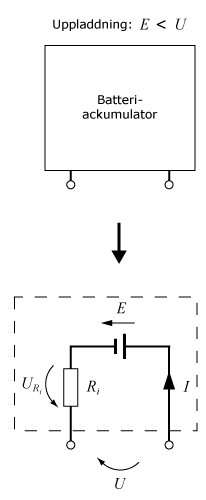
Enligt Kirchoffs spänningslag är U = I·Ri + E.
Om man förlänger detta uttryck med I så får man sambandet mellan tre
effekter:
U·I = I2·Ri + E·I
Produkten U·I är effekten till eller från batteriet. I2·Ri är effektförlusten inuti batteriet och
E·I motsvarar den kemiska energi som tas ur eller lagras i batteriet. Om man "överladdar" ett batteri så står även produkten E·I för förluster.
Batterispänning och laddningstillstånd UPP ↵
Den vanligaste batterispänningen som brukar användas i båtar är 12 V. I den fuktiga, marina miljön är det fördelaktigt med låga spänningar med tanke på säkerheten. Den spänning som batterier kan ta emot och avge är likspänning, därför likriktas strömmen från båtgeneratorn och endast förbrukare som är avsedda för likström kan användas.
Ett 12 volts blybatteri består av sex seriekopplade celler. Den högsta cellspänning som kan uppnås är 2,12 V. När batteriet är fulladdat ska batterispänningen således vara 12,72 V. Detta gäller då batteriet varken belastas eller laddas.
För att få en uppfattning om hur mycket laddning som finns kvar i ett batteri kan man med en voltmeter skaffa sig en grov bild av batteriets tillstånd. Då man mäter spänningen mellan batteripolerna är det viktigt att ta hänsyn till batteriets befinnande, och man särskiljer tre fall:
1. Batteriets vilospänning
Vilospänningen mäter man när batteriet varken laddas eller belastas. I mätningen ska man ta hänsyn till varje tiondels volt. Det är avgörande för att få besked om batteriets status.
2. Polspänningen vid förbrukning
När man börjar att ta ut ström från batterierna sjunker polspänningen genast. En enda glödlampa innebär att spänningen går ned med 0,2 V på kort tid. Friska batterier med ett jämnt strömuttag har en polspänning på mellan 11,5 V - 12 V. Vid mycket stor förbrukning, till exempel då man kör ett ankarspel, sjunker ofta polspänningen till ca 10,5 V. Spänningen bör stiga igen när förbrukningen blir normal. Om spänningen sjunker under 11 V vid jämn förbrukning ska man ej ta ut mer ström utan att först ladda batterierna. Är spänningen under 10,5 V kan batterierna bli varaktigt försvagade.
3. Polspänningen vid laddning
Direkt när laddningen har påbörjats ökar polspänningen ganska snabbt. Om batteriets laddningsnivå är låg kommer det initialt att fylla på med mycket laddning, batterispänningen är i detta fall mellan 13,2 - 13,8 V. Allt eftersom som batteriet fylls på minskar laddströmmen och spänningen stiger över 14 V. När polspänningen är över 14,4 V, och det knappt går någon ström alls, kan batteriet antas vara fulladdat.
Då batteriernas laddningsnivå ska kontrolleras i samband med laddning använder man också en amperemeter för kompletterande strömmätning. När strömmen är stor, kanske upp till generatorns övre gräns, 50 A, är batteriet mycket urladdat. När batteriet fylls på går den kemiska processen långsammare. Det flyter mindre ström, runt 10 A. För att slutligen, när batteriet är fulladdat, avtar strömmen nästan helt.
Batterikontroll med syraviktsmätningUPP ↵
Ett annat sätt att uppskatta laddningsmängden i en ackumulator är genom att mäta elektrolytens densitet. Eftersom koncentrationen hos elektrolytens svavelsyra följer ackumulatorns laddningstillstånd kan detta bedömas utifrån elektrolytens densitet ("syravikt") eller brytningsindex. Mätningen görs med en syraprovare (oftast en areometer respektive refraktometer som mäter brytningsindex).
En syramätare består av en glaskolv, upptill försedd med en sugblåsa och nedtill med ett rör. Inne i glaskolven ligger en flottör försedd med en skala som visar olika specifika vikter. Genom att med gummiblåsan suga upp elektrolyt i kolven får man flottören att flyta fritt. Vätskenivåns höjd på flottörskalan visar syravikten, och ju högre flottören flyter desto starkare är syrakoncentrationen. Elektrolytens specifika vikt är vid +25 °C 1,280 g/cm3, då är batteriet fulladdat. I nedanstående tabell visas exempel på syravikter för olika laddningstillstånd.
En enkel tumregel mellan syradensitet och vilospänning
Det finns ett visst samband mellan elektrolytens densitet och batteriets vilospänning. Om man till värdet på syradensiteten, uttryckt i g/cm3, adderar 0,84 erhåller man vilospänningen per battericell, uttryckt i enheten volt.
| Elektrolytens specifika vikt vid +25 °C | Batteriets laddtillstånd | Vilospänning per battericell | ||
| 1,280 g/cm3 | 100 % | 2,12 V | ||
| 1,250 g/cm3 | 75 % | 2,09 V | ||
| 1,220 g/cm3 | 50 % | 2,06 V | ||
| 1,190 g/cm3 | 25 % | 2,03 V | ||
| 1,160 g/cm3 | svagt | 2,00 V | ||
| 1,130 g/cm3 | urladdat | 1,97 V |
Temperaturkorrigering vid avläsning av syravikten
Syramätarens flottörskala är normalt baserad på en syratemperatur vid +25 °C. För avvikande temperaturer som är mycket högre eller lägre måste avläsningsvärdet korrigeras. Särskilt gäller detta vid mycket låga temperaturer, som det kan bli vintertid. Om syratemperaturen är mellan +22 - +28 °C behöver ingen korrigering göras. För var 10:e grad över +25 °C ska man lägga till 0,007 g/cm3, och för var 10:e grad under +25 °C drar man av 0,007 enheter.
Inbyggda flottörer
I vissa ackumulatorer byggs små, utifrån synliga flottörer in, vilka flyter så länge ackumulatorn är laddad och batterisyran är tung. En kula som är röd markerar ett helt urladdat batteri. En annan kula är gul och markerar halvladdat batteri. En tredje kula är grön och markerar fulladdat batteri. Varje kula har en avpassad densitet, så att de sjunker en och en i proportion till elektrolytens densitet. Beroende på läget hos dessa kulor kan man enkelt se ackumulatorns laddningstillstånd.
Varning för knallgas! UPP ↵
Under laddningsprocessen frigörs både syre och väte i gasform. Gasen syns som små pärlor på elektrodplattorna. Så länge som sulfatjonerna återupptas av elektrolyten skapas bara lite gas. Men, fortsätter man att tillföra laddningsström sedan allt svavel återgått till syran startar en process som delar upp vattnet i batteriet. Det kommer då att bildas syrgas på plusplattorna och vätgas på minusplattorna. Det får till följd att det börjar bubbla friskt och när de två gaserna förenas i luften ovanför elektrolyten bildas knallgas. Knallgas är lättantändlig och mycket explosiv! Ett båtbatteri kan innehålla tillräckligt med vatten som, om allt det förvandlas till knallgas, kan spränga en båt i luften. Det är därför viktigt att man först och främst förhindrar att ackumulatorerna blir överladdade, men att de också för säkerhets skull placeras i ett ventilerat utrymme.
Koppla ihop batterier UPP ↵
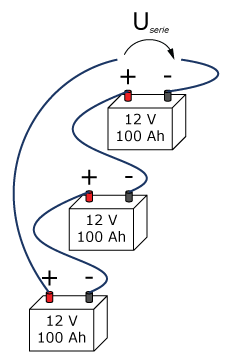
Ett antal batterier kan kopplas samman och beroende på om de ansluts parallellt eller i serie erhåller man högre laddningskapacitet, alternativt högre spänning. Den totala energimängden kommer att öka lika mycket i bägge kopplingarna, oavsett kopplingstyp. Genom att kombinera parallellkoppling med seriekoppling kan man få både högre laddningskapacitet och högre spänning. Exempelvis om man har sex stycken 12 voltsbatterier á 100 Ah varav tre batterier sätts samman med parallellkoppling och sedan ansluts i serie med de återstående tre batterierna, vilka också är parallellkopplade med varandra, då får man en batteribank på 300 Ah och 24 V.
Batteriets polmärkning
Det förekommer lite olika varianter på hur ett batteris poler markeras. Den positiva polen betecknas med: röd färg, bokstaven P eller ett plus tecken. Den negativa polen kan ha: svart, blå eller gul märkning, bokstaven N eller ett minus tecken. Om märkningen är otydlig kan man också avgöra vilken pol det är genom att se på polkontaktens storlek. Den positiva polen är alltid den tjockaste av de runda polanslutningarna.
|
Parallellkoppling Om man kopplar plus till plus och minus till minus för samtliga batterier, kommer kapaciteten (Ah) att öka för varje batteri som man lägger till, men spänningen (V) mellan ledarändarna är densamma. |
Seriekoppling Om man istället kopplar pluspol till minuspol hela vägen för samtliga batterier, då ökar spänningen (V) och kapaciteten (Ah) kommer att vara oförändrad. |

|
|
|
Parallellkoppling Om man kopplar plus till plus och minus till minus för samtliga batterier, kommer kapaciteten (Ah) att öka för varje batteri som man lägger till, men spänningen (V) mellan ledarändarna är densamma. |

|
|
Seriekoppling Om man istället kopplar pluspol till minuspol hela vägen för samtliga batterier, då ökar spänningen (V) och kapaciteten (Ah) kommer att vara oförändrad. |

|
Urladdningskurva och kapacitetstal UPP ↵
Kapaciteten i ett batteri motsvaras av den laddningsmängd som finns upplagrat i batteriet, d.v.s den elektrokemiska potential i ackumulatorns aktiva material. Laddningskapaciteten uttrycks i enheten amperetimmar [Ah].
Ett batteris kapacitetstal beskriver batteriets laddningskapacitet i förhållande till en tidsfaktor. Kapacitetstalet betecknas med C och är baserat på urladdningskurvor från verkliga urladdningsexperiment. Urladdningen sker med en konstant ström vid 25 °C tills att batterispänningen sjunkit till ett slutvärde, EODV (End Of Discharge Voltage), typiskt 10,5 V. Kurvans mittpunkt kallas för MPV (MidPoint Voltage) och det är detta värde som brukar uppges som batteriets polspänning. Se figuren.

Urladdningens tid anges som ett index till kapacitetstalet. C20 = 60 Ah, vilket innebär att urladdningen pågått i 20 timmar och att batteriets kapacitet I·t var 60 Ah. Den konstanta urladdningsströmmen I som i detta fall användes var alltså 60/20 = 3 A.
Två exempel på kapacitetsberäkningar UPP ↵
1. Antag att ett batteri med kapacitetstalet C20 = 60 Ah används till en glödlampa med en strömförbrukning på 1 A. Hur länge räcker batteriet?
Kapacitetstalet är framtaget vid strömmen 3 A. Då kan man utgå ifrån att batteriets kapacitet är oförändrad vid det närliggande strömvärdet 1 A. Den tid som batteriet kan räcka är således:
t = C/I = 60 Ah/1 A = 60 h.
Svar: Batteriet kan hålla glödlampan tänd i 60 timmar.
2. Antag nu att batteriet ska driva en startmotor som "drar" strömmen 200 A. Hur länge räcker batteriet?
Den höga strömmen 200 A är ett helt annat driftfall än det som använts av fabrikanten för att ta fram kapacitetstalet. Av erfarenhet (här givet) vet man att batteriets kapacitet blir sämre vid höga strömmar. Om man i detta fall räknar med att kapacitetstalet reducerats till 70 % erhålls kapacitetstalet C':
C' = 0,7·C = 0,7·60 Ah = 42 Ah.
Det omräknade kapacitetstalet ger:
t = C'/I = 42 Ah/200 A = 0,21 h → 0,21 h·60 = 12,6 min.
Svar: Motorn bör starta inom 12,6 minuter, batteriet är sedan urladdat.
Kylans inverkan på batterietUPP ↵
Polspänningen hos ett batteri som urladdas påverkas av vilken syrakoncentration elektrolyten närmast metallplattornas ytor har. När syran har bundit sig kemiskt till plattornas aktiva massa, sjunker polspänningen till dess ny syra från den övriga elektrolyten hinner tränga in i porerna. Då strömuttag sker vid låga temperaturer kommer polspänningen att falla snabbare. Detta beror på att svavelsyran blir mer trögflytande och molekylvandringen mellan elektrolyt och elektroder går saktare ju lägre temperaturen är. Hur kylan inverkar på urladdningen av ett från början fulladdat batteri framgår av följande exempel:
| Temperatur | Reell kapacitet | |
| +27 °C | 100 % | |
| 0 °C | 70 % | |
| -18 °C | 50 % |
Vid fallande temperaturer minskar kapaciteten med 1,1 - 1,2 % per °C. Notera också att starteffekten vid motorstart reduceras ytterligare p.g.a. att oljan blir trögare. Men, detta är ju naturligtvis sällan man behöver ta hänsyn till som båtägare.
Elektrolytens fryspunkt beror på svavelsyrans densitet, här listas olika syrakoncentrationer och vilka temperaturer de fryser vid:
| Syradensitet | Fryspunkt | |
| 1,100 g/cm3 | -8 °C | |
| 1,150 g/cm3 | -15 °C | |
| 1,200 g/cm3 | -27 °C | |
| 1,250 g/cm3 | -52 °C | |
| 1,280 g/cm3 | -68 °C |
CCA - cold cranking amperes UPP ↵
Beteckningen CCA står för det engelska uttrycket: cold cranking amperes. CCA anger ett batteris köldstartsström och är ett mått på den ström som ett batteri kan leverera under särskilda villkor. Klassificeringen definieras som mängden ström ett blybatteri vid -18 °C (0 °F) kan avge i 30 sekunder och fortfarande behålla minst 1,2 V per cell (7,2 V för ett 12 voltsbatteri).
Andra klassificeringar som förekommer är MCA och HCA. MCA = marine cranking amperes anger den ström som ett blybatteri kan avge vid 0 °C (32 °F) i 30 sekunder tills att det återstår 1,2 V per cell. HCA = hot cranking amperes och är den ström som ett blybatteri kan avge vid 26,7 °C (80 °F) i 30 sekunder tills att det återstår 1,2 V per cell.
CCA är ett mer krävande test än de som utförs vid högre temperaturer. För jämförelser mellan olika batterityper är CCA den vanligaste klassificeringen och den mest intressanta. Två batterier kan ha samma Ah men olika köldstartseffekt.
Det finns olika standarder för CCA. I Sverige används än så länge DIN och SAE, men EN-normen börjar bli alltmer vanlig.
| CCA standard | Ursprungsnation | Urladdningstid | Temperatur | Lägsta cellspänning |
| DIN | Tyskland | 30 sekunder | -18 °C | 1,5 V |
| SAE | USA | 30 sekunder | -18 °C | 1,2 V |
| EN | Europa | 10 sekunder | -18 °C | 1,25 V |
| IEC | Asien | 60 sekunder | -18 °C | 1,4 V |
| CCA standard | Ursprungsnation | Urladdningstid | Temperatur | Cellspänning min |
| DIN | Tyskland | 30 s | -18 °C | 1,5 V |
| SAE | USA | 30 s | -18 °C | 1,2 V |
| EN | Europa | 10 s | -18 °C | 1,25 V |
| IEC | Asien | 60 s | -18 °C | 1,4 V |
RC - reservkapacitet UPP ↵
Reservkapaciteten anger det antal minuter som ett fulladdat batteri vid +25 °C kan laddas ur med en urladdningsström på 25 A, tills att slutspänning mäter 1,75 V per cell.
SjälvurladdningUPP ↵
I ett batteri som står oanvänt sker det konstant en mindre urladdning. Det kallas batteriets självurladdning och den kan variera stort beroende på temperaturen och batteriets kondition. Självurladdningen ökar ju högre temperaturen är, och därför bör batterier förvaras svalt. Vid rumstemperatur kan självurladdningen vara 0,1 - 0,2 % av batteriets kapacitet. Vilket innebär att ett nytt batteri på 100 Ah har en självurladdning på 1 - 2 Ah per 10 dygn. Gamla batterier har väsentligt högre självurladdning. Ett batteri som blir stående i rumstemperatur under flera månader utan laddning kan bli helt förstört. Man bör därför vara noga med att ladda sina batterier var 3:e till 6:e månad. Om batteriet först fulladdas och sedan förvaras svalt och torrt, kan det lagras under en längre tid utan laddning.
BatteriskötselUPP ↵
För att erhålla lång hållbarhet hos ett batteri och optimera dess laddningskapacitet behöver det skötas. Ta del av dessa råd gällande skötseln av en blyckumulator. Underhållet är enkelt, men avgörande för hur länge man har en väl fungerande ackumulator.
Underhållsfria ackumulatorerUPP ↵
Battericellernas metallplattor består av en mjuk blymassa som sitter i ett ramverk. Det mjuka blyet är förstärkt med en legering. Till denna legering har man länge använt antimon för att öka blyets hårdhet. Antimon är ett halvmetalliskt grundämne. Men, en nackdel med legeringen är att den "förgiftar" batteriet, vilket får till följd att batteriet förbrukar vatten ur elektrolyten. Moderna batterier har bara 1,5-2 % antimon i ramverket, medan i äldre batterier kan det vara upp till 7 %. Det gör att de äldre ackumulatorerna har styvare ramverk och längre livslängd, men de förbrukar också mer vatten. Specialbatterier för marint bruk är ofta av den här typen.
För att minska behovet om påfyllning av vatten, men samtidigt öka plattornas styvhet, har man börjat använda kalcium i ramverket istället för antimon. Blykalciumbatterier ger flera fördelar: det tål upp till 15 V innan det börjar att gasa och det förbrukar betydligt mindre vatten. Nackdelen är dock att blykalciumbatterierna inte klarar djupa urladdningar så bra. Tar man ut för mycket laddning, riskerar man att inte få liv i det igen. De bästa båtbatterierna är därför s.k. hybridbatterier, där minusplattorna har kalciumförstärkt ramverk medan plusplattorna har ett antimonförstärkt ramverk (eller vice versa beroende på tillverkare). Man kan säga att dessa batterier är nästan underhållsfria.
De batterier som man vanligtvis menar när man talar om underhållsfria batterier är i sin enklaste form lågantimonbatterier med extra mycket vätska ovanför cellplattorna. De finare och dyrare varianterna av underhållsfria batterier är hybridbatterier eller batterier med kalciumförstärkt ramverk, även de med högre elektrolytnivå ovanför plattorna.
Notera dock att helt underhållsfria batterier finns inte. Trots att de underhållsfria batterierna är förseglade - det saknas proppar för att kontrollera vätskenivån - så går det att fylla på vatten. Om man tittar närmare kan man hitta lock som går att fälla upp. Vätskenivån i "underhållsfria" batterier bör kontrolleras och fyllas på minst en gång vartannat år.
BatterisäkerhetUPP ↵
När man använder batteriackumulatorer finns det vissa säkerhetsaspekter som man bör beakta. Några har nämnts här i texten redan, och i detta avsnitt sammanfattas vilka riskfaktorer man främst ska tänka på och hur man undviker dem, så att batterierna ombord hanteras på ett tryggt och säkert sätt.